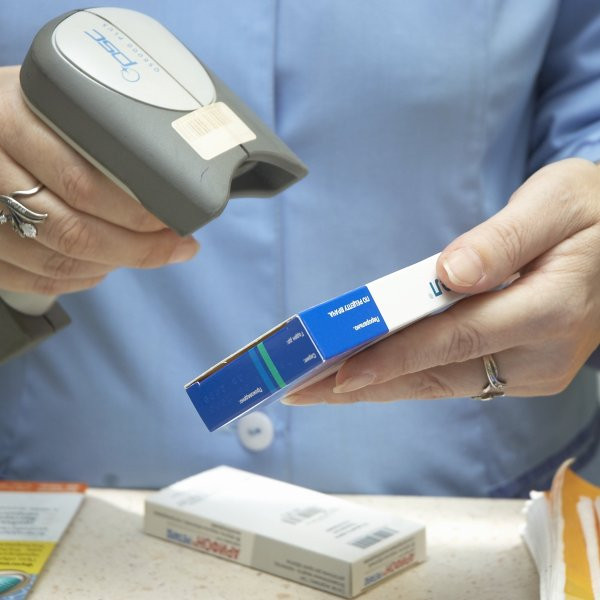
Система отслеживания дешевых контрафактных лекарств защитит потребителя и освободит рынок для добросовестных отечественных производителей
Наступивший 2018 год должен принципиально изменить положение дел на рынке фармацевтической продукции Российской Федерации: отныне лекарственные препараты будут маркироваться по установленному образцу для осуществления централизованного мониторинга за их движением. Внедрение системы планируется завершить до конца года.
Как решают проблему защиты рынка лекарств от подделок на Западе
Первыми американскими штатами, в которых были утверждены законопроекты, предписывающие идентифицировать упаковку лекарств посредством специальной маркировки, стали Калифорния (2004 г.) и Флорида (2006 г.).
Главное отличие между европейской и американской системами – порядок проведения проверки аутентичности упаковки. Если в США он должен происходить при каждой передаче препарата от собственника к собственнику, то в Европе подлинность проверяется только при передаче лекарства потребителю.
Длительные сроки разработки и внедрения систем мониторинга на обоих континентах связаны не только с технической сложностью реализации подобных проектов, но и с необходимостью существенных затрат.
Какие меры планируется принять в России
Контроль подлинности упаковки, как и в США, должны будут проводить все субъекты, принимающие участие в процессе перемещения препаратов от производителя к потребителю.
Чем привлекательно открытие фармпредприятия в РФ в нынешних условиях
Одновременно с защитой потребителей следствием внедрения системы мониторинга станет освобождение от контрафактных лекарств и фальсификата занимаемой ими ниши. А это значит, что поддерживаемые государством отечественные производители получать возможность быстрее выводить на рынок оригинальные препараты и дженерики, если они смогут уверенно конкурировать с импортными аналогами не только за счет более низких цен, но и по своей эффективности и безопасности.
В том числе, у нас можно заказать:
- Химические реактивы фармацевтического качества производства французской компании Biochem, производство которых ведется из высокосортного сырья на собственных промышленных мощностях с использованием современного интеллектуального оборудования и многоступенчатым контролем в соответствии с действующими европейскими и международными нормативами.
- Многоцелевое пилотное оборудование для R&D сектора немецкой марки Pharmag, включая универсальный привод UAM и сменные насадки – лабораторную месильную машину LMZ-5, различные виды смесителей для порошков, гранул, паст, мазей и жидкостей, дозаторы, мельницы, грануляторы, пеллетайзер, коатер, полировальный барабан, гомогенизатор, аппарат для отливки свечей.
- Эксцентриковые и роторные таблеточные прессы для организации опытного и мелкосерийного производства таблетированных препаратов аргентинской компании Riva. Одно из основных преимуществ аппаратов данной марки – отсутствие проблем при масштабировании технологии на промышленные таблетпрессы различных производителей.
- Анализаторы универсального назначения и специализированные тестеры для контроля физико-химических свойств и технологических характеристик обрабатываемых субстанций, микробиологической чистоты материалов и окружающей среды, других параметров. Все реализуемое оборудование проходит предпродажную проверку и калибровку, устанавливается в лаборатории заказчика, настраивается в рабочий режим, берется на гарантийное и, при имеющейся необходимости, текущее сервисное обслуживание.
- Специализированную лабораторную мебель и посуду, расходные материалы и комплектующие.